- 当前位置:
- 首页
- >
- 成果转换
- >
- 一种放射性核素标记化合物及其制备方法和应用
一种放射性核素标记化合物及其制备方法和应用
- 分享到:
 项目计划总投入:30万元
项目计划总投入:30万元 奖励金额:面议
奖励金额:面议  单位名称:厦门大学附属翔安医院
单位名称:厦门大学附属翔安医院 所属领域:生物医药与大健康
所属领域:生物医药与大健康 技术需求类型:关键难题
技术需求类型:关键难题 期望合作方式:技术转让
期望合作方式:技术转让 联系人:张**
联系人:张** 联系电话:18120758432
联系电话:18120758432
我要揭榜

 成果介绍
成果介绍
技术领域
本发明属于医学影像学技术领域,具体涉及一种放射性核素标记化合物及其制备方法和应用。
背景技术
传统的靶向诊断和治疗药物(抗体、多肽、糖、脂质等)由于受到肿瘤本身受体表达数量(肿瘤细胞:105-106/细胞VS正常细胞:104-105/细胞)的限制,不足以赋予其较高的选择性,导致较低的癌症靶向效率,限制了其在肿瘤诊断和治疗中的应用。非天然糖代谢利用带有化学标签的单糖分子修饰细胞膜,实现靶向标签成百上千倍的增加。该技术已广泛用于癌症标记和靶向治疗。通过发展一种基于糖代谢的放射性核素标记策略,利用放射性同位素标记小分子与糖代谢化学靶标通过体内正交反应共价结合,能够实现稳定、灵敏、快速响应的放射性核素标记。同时,通过人为的添加标记靶点可以实现靶向信号放大,增加肿瘤的核素富集的同时减少正常组织器官非特异摄取,对于肿瘤的诊断和治疗具有重要意义。
基于糖代谢和点击化学反应的标记策略具有以下优点:首先,较小的化学标签能够以高密度展示在细胞表面,从而提高靶向效率;其次,共价连接的放射性小分子相较于非共价配体与受体的结合更加稳定,这有利于放射性核素在靶点的富集与滞留。这项技术已广泛应用于癌症标记和靶向治疗。总之,在人体内使用非天然糖进行点击化学反应具有推动药物开发并改善疾病诊断与治疗的潜力。需要进一步研究以全面了解糖代谢和放射性核素标记的安全性和有效性。这一策略涉及开发可以与放射性同位素标记的小分子,并通过体内正交反应与糖代谢靶点共价结合,从而实现稳定、快速的放射性核素标记。此外,引入标记靶点可以放大信号,并增加肿瘤中放射性同位素的积累,同时减少正常组织的非特异性摄取。这一方法在肿瘤诊断和治疗中具有巨大的潜力。
发明内容
本发明目的在于克服现有技术缺陷,提供一种放射性核素标记化合物。
本发明的另一目的在于提供上述放射性核素标记化合物的制备方法。
本发明的再一目的在于提供上述放射性核素标记化合物的应用。
本发明的技术方案如下:
一种放射性核素标记化合物,其结构式为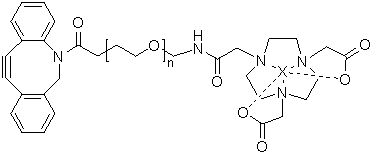
或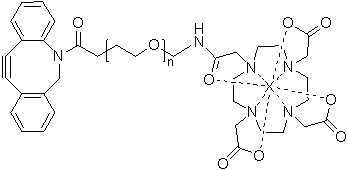 ,其中,X为放射性核素,且n为整数,n≥0。
,其中,X为放射性核素,且n为整数,n≥0。
在本发明的一个优选实施方案中,所述X为18F、99mTc、177Lu、111In、157Gd、64Cu和67/68Ga中的至少一种。
上述放射性核素标记化合物的制备方法,包括如下步骤:
(1)将DBCO-PEGn-amine在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐作为催化剂的条件下与NOTA-NHS或DOTA-NHS反应,制得标记前体NOTA-DBCO或DOTA-DBCO;
(2)将步骤(1)制得的标记前体NOTA-DBCO或DOTA-DBCO溶于醋酸钠溶液中,然后加入所述X的前体进行反应,再经纯化后,即得。
在本发明的一个优选实施方案中,所述步骤(1)为:将1当量的DBCO-PEGn-amine在2-5当量的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐作为催化剂的条件下与1-5当量NOTA-NHS或DOTA-NHS反应,制得标记前体NOTA-DBCO或DOTA-DBCO。
进一步优选的,所述步骤(1)的反应的温度为4℃,时间为24-72h。
在本发明的一个优选实施方案中,所述步骤(2)为:将1当量步骤(1)制得的标记前体NOTA-DBCO或DOTA-DBCO溶于0.1-0.5 M的醋酸钠溶液中,然后加入所述X的前体进行反应,再经C18柱纯化后,即得;其中,每100 μg标记前体NOTA-DBCO或DOTA-DBCO对应加入185- 370 MBq的所述X的前体。
进一步优选的,所述步骤(2)的反应的温度为20-100℃,时间为10-30min。
上述放射性核素标记化合物在制备体内癌症靶向显像检测探针中的应用。
上述放射性核素标记化合物在制备癌症放射性核素治疗试剂盒中的应用。
一种癌症放射性核素治疗试剂盒,具有上述放射性核素标记化合物。
本发明的有益效果是:
1、本发明能够通过点击化学反应实现非天然糖代谢化学标记的肿瘤的放射性核素的标记,可用于体内癌症检测,具有更短的成像时间、更高的成像质量、更广的成像深度以及更少的肾脏放射性积累等优点,更有利于早期癌症的检测。同时,通过联合CT成像可得到精确的解剖学结构信号和功能信息,有利于癌症的评估以及精确分期。
2、本发明具有标记条件温和、标记时间短、标记产率高等特点,无须后续纯化即可使用,更加有利于标记物的商业化应用与临床推广。
3、本发明中的多聚体有利于提高比活度,通过PET/SPECT仪器扫描能够得到高质量的显像结果,能够在体实时动态癌症进展监测。
4、本发明的制备思路扩展性强,靶向基团可任意替换为其他常用靶向分子,从而获得不同靶向功能的可用于不同核素标记的分子靶向探针。
5、与现有技术相比,本发明具有更短的成像时间、更高的成像质量以及更广的成像深度等优点,更利于其在临床中的应用。
附图说明
图1为本发明实施例1的基本原理图,其中,a为NOTA-DBCO的合成路线图,b为18F-NOTA-DBCO标记示意图。
图2为本发明实施例1中NOTA-DBCO通过HPLC测出的紫外吸收标准曲线图。
图3为本发明实施例1中NOTA-DBCO的MODI-TOF-MS质谱分析图。
图4为本发明实施例1中18F-NOTA-DBCO标记HPLC测出的紫外吸收标准曲线图。
图5为本发明实施例2中 18F-NOTA-DBCO小鼠PET/CT显像图像。其中,A为空白对组小鼠的MIP图,B为Ac4ManNAz预处理的实验组小鼠的MIP图。
图6为本发明实施例3中18F-NOTA-DBCO与Ac4ManNAz的体外点击化学反应验证实验结果图。
图7为本发明实施例1的基本原理图,其中,a为DOTA-DBCO的合成路线图,b为68Ga-DOTA-DBCO O标记示意图。
图8为本发明实施例4中DOTA-DBCO通过HPLC测出的紫外吸收标准曲线图。
图9为本发明实施例4中DOTA-DBCO的MODI-TOF-MS质谱分析图。
图10为本发明实施例4中68Ga-DOTA-DBCO标记HPLC测出的紫外吸收标准曲线图。
图11为本发明实施例6中 68Ga-DOTA-DBCO小鼠PET/CT显像图像。其中,A为空白对组小鼠的MIP图,B为Ac4ManNAz预处理的实验组小鼠的MIP图。
图12为本发明实施例6中68Ga-DOTA-DBCO与Ac4ManNAz的体外点击化学反应验证实验结果图。
具体实施方式
以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述。
实施例1 NOTA-DBCO的制备与18F标记
(1)NOTA-DBCO的合成:18F-NOTA-DBCO的合成路线如图1所示。首先,将少量的DBCO和NOTA-NSH分别溶解在DMSO溶液中,并用水稀释。然后,取小量的每种溶液,并通过HPLC分析来确定UV吸收的峰保留时间。通过对比的DBCO, NOTA-NSH与反应液的出峰时间,DBCO在该流动相中,出峰时间为16.7685 min,而反应液的出峰时间在16.677 min,在所需峰值处收集洗脱液,经过冷冻干燥后,得到NOTA-DBCO。如图2所示。HPLC条件:流动相由乙腈-水线性浓度梯度从5%(体积/体积)至95%(体积/体积)在30min内进行。分析时流速保持为1 mL/min。
(2)NOTA-DBCO的表征:MODI-TOF-MS质谱分析,测得NOTA-DBCO的平均分子量562.2642,与NOTA-DBCO的相对分子质量相符合。如图3所示。
(3)NOTA-DBCO的18F标记与鉴定:将50 μL的Na18F溶液和50 μL的2 mM氯化铝加入一个小瓶中。将瓶子在95°C下搅拌15min。然后,向同一个瓶子中加入50 μg的NOTA-DBCO,100 μL的醋酸-乙酸钠缓冲液(pH=4)和100 μL无水乙醇。将瓶子在95°C下再次搅拌15min,得18F-NOTA-DBCO。为了纯化18F-NOTA-DBCO,将反应混合物缓慢注入C18柱中。注入10 mL去离子水到柱中,收集洗脱液。再注入1 mL无水乙醇到柱中,收集洗脱液。通过HPLC分析 18F-NOTA-DBCO的放射化学纯度>95%。如图4所示。
实施例2 实施例1制得的18F-NOTA-DBCO PET/CT荷瘤小鼠显像
(1)荷瘤小鼠模型的构建:本实施例的实验所用小鼠为雌性4-6周龄C57BL/6小鼠,购于厦门大学实验动物中心。常规培养4T1肿瘤细胞,收集生长良好的肿瘤细胞,用PBS缓冲液将离心后的细胞重悬,将细胞浓度调整为5×106 cell/100 μL,放入冰盒中以备用。提前一天对小鼠右上肢进行脱毛,将脱毛后的小鼠麻醉,用75%的酒精擦拭右上肢皮肤,以每只接种100 μL的细胞悬液为标准,快速接种于小鼠右上肢皮下,待注射结束,注射部位呈皮球状,将已经接种的小鼠放回IVC鼠笼继续饲养,定期观察小鼠的存活状态及接种部位的成瘤情况。等到肿瘤直径生长至5-10 mm时即可用于实验。
(2)18F-NOTA-DBCO PET/CT全身静态扫描:取4T1皮下瘤小鼠7只,随机分成2组,分别为实验组(n= 4)和对照组(n= 3)。实验组正在显像前连续三天瘤内注射Ac4ManNAz 8mg/kg,对照组注射相同体积的生理盐水。
成像前将小鼠用异氟烷吸入式麻醉,使小鼠处于静息状态。每只小鼠通过尾静脉注射18F-NOTA-DBCO(100 μCi/100 μL )后,以俯卧位的方式安置在小鼠床位上并进行Micro PET/CT成像。每只鼠采集60 min的动态数据,重建后计算每克百分注射剂(%ID/g )。
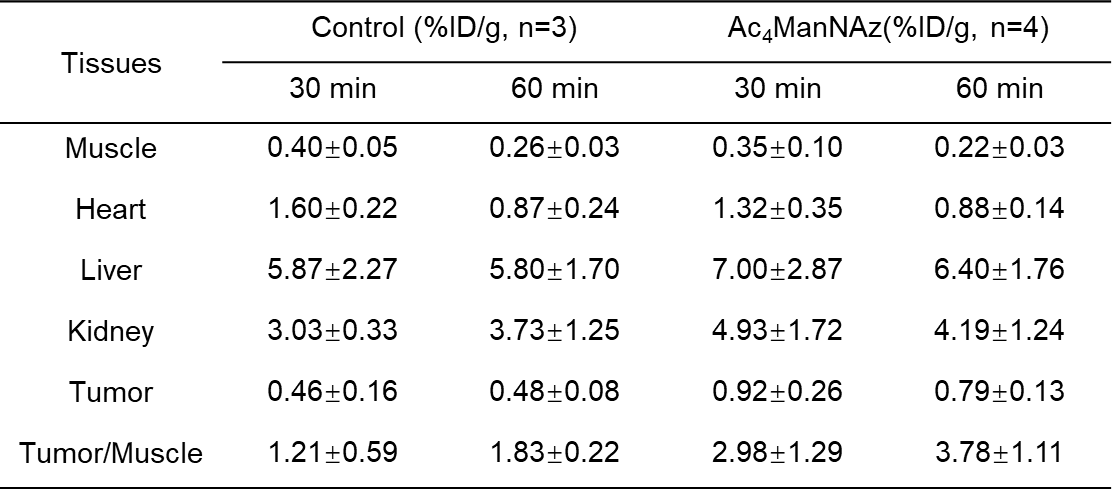
PET 图像采用的3D OPMAP算法进行重建和数据 衰减校正。选取肿瘤、心脏、肝脏、肾脏、肌肉等感兴趣区的%ID/g。使用Origin 软件计算肿瘤以及肌肉部位的18F-NOTA-DBCO的富集比值。通过图5可以清晰地观察到,在注射18F-NOTA-DBCO尾静脉注射后,实验组和对照组的肿瘤摄取均随时间逐渐降低,肝、肾、膀胱摄取存在较高非特异性摄取。对照组和实验组肿瘤摄取虽然随着时间逐渐降低,但是实验组下降速率显著慢于对照组。实验组瘤肉比显著高于对照组,对照组vs实验组Tumor/Muscle(30min)= 1.21±0.59 vs 2.98±1.292,P< 0.05,对照组vs实验组Tumor/Muscle(60min)= 1.83±0.22 vs 3.78±1.11,P< 0.05。此外,本实施例中18F-NOTA-DBCO在荷瘤小鼠体内生物分布数据如表1所示。
表1
实施例3 与Ac4ManNAz的体外点击化学反应验证
实施例1制得的18F-NOTA-DBCO与Ac4ManNAz的体外点击化学反应如图6所示,18F-NOTA-DBCO与Ac4ManNA孵育5 min,出现的新的反射峰,说明形成了新的放射性化合物,并且新放射峰的面积远远大于18F-NOTA-DBCO的放射峰面积。孵育30 min时,已经完全生成新的放射峰,证明18F-NOTA-DBCO已经被完全反应。由此可知,18F-NOTA-DBCO与Ac4ManNAz的点击化学反应在PBS溶液中可行,并且效率高。
实施例4 DOTA-DBCO的制备与68Ga标记
(1)DOTA-DBCO的合成:68Ga-DOTA-DBCO的合成路线如图7所示。首先,将少量的DBCO和DOTA-NSH分别溶解在DMSO溶液中,并用水稀释。然后,取小量的每种溶液,并通过HPLC分析来确定UV吸收的峰保留时间。通过对比的DBCO, DOTA-NSH与反应液的出峰时间,DBCO在该流动相中,出峰时间为15.276 min,而反应液的出峰时间在16.614 min,在所需峰值处收集洗脱液,经过冷冻干燥后,得到DOTA-DBCO。如图8所示。HPLC条件:流动相由乙腈-水线性浓度梯度从5%(体积/体积)至95%(体积/体积)在30min内进行。分析时流速保持为1 mL/min。
(2)DOTA-DBCO的表征:MODI-TOF-MS质谱分析,测得DOTA-DBCO的平均分子量663.1795,与DOTA-DBCO的相对分子质量相符合。如图9所示。
(3)DOTA-DBCO的68Ga标记与鉴定:取3 mL的68GaCl3溶液于10 mL负压瓶。然后,向同一个瓶子中加入50 μg的DOTA-DBCO,1.5 mL的 0.25 M的醋酸-乙酸钠缓冲液(pH=4)。将瓶子在90°C下震荡10min,得68Ga-DOTA-DBCO。为了纯化68Ga-DOTA-DBCO,将反应混合物缓慢注入C18柱中。注入10 mL去离子水到柱中,收集洗脱液。再注入1 mL无水乙醇到柱中,收集洗脱液。通过HPLC分析 68Ga-DOTA-DBCO的放射化学纯度>98%。如图10所示。
实施例5 实施例1制得的68Ga-DOTA-DBCO PET/CT荷瘤小鼠显像
(1)荷瘤小鼠模型的构建:本实施例的实验所用小鼠为雌性4-6周龄C57BL/6小鼠,购于厦门大学实验动物中心。常规培养B16肿瘤细胞,收集生长良好的肿瘤细胞,用PBS缓冲液将离心后的细胞重悬,将细胞浓度调整为2×105 cell/100 μL,放入冰盒中以备用。提前一天对小鼠右上肢进行脱毛,将脱毛后的小鼠麻醉,用75%的酒精擦拭右上肢皮肤,以每只接种100 μL的细胞悬液为标准,快速接种于小鼠右上肢皮下,待注射结束,注射部位呈皮球状,将已经接种的小鼠放回IVC鼠笼继续饲养,定期观察小鼠的存活状态及接种部位的成瘤情况。等到肿瘤直径生长至5-10 mm时即可用于实验。
(2)68Ga-DOTA-DBCO PET/CT全身静态扫描:取4T1皮下瘤小鼠7只,随机分成2组,分别为实验组(n= 4)和对照组(n= 3)。实验组正在显像前连续三天瘤内注射Ac4ManNAz 8mg/kg,对照组注射相同体积的生理盐水。
成像前将小鼠用异氟烷吸入式麻醉,使小鼠处于静息状态。每只小鼠通过尾静脉注射68Ga-DOTA-DBCO(100 μCi/100 μL )后,以俯卧位的方式安置在小鼠床位上并进行Micro PET/CT成像。每只鼠采集60 min的动态数据,重建后计算每克百分注射剂(%ID/g )。
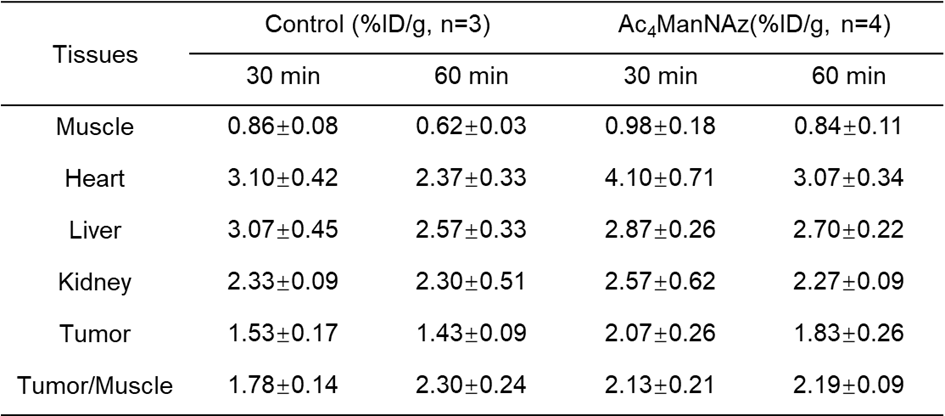
PET 图像采用的3D OPMAP算法进行重建和数据 衰减校正。选取肿瘤、心脏、肝脏、肾脏、肌肉等感兴趣区的%ID/g。通过图11可以清晰地观察到,在注射68Ga-DOTA-DBCO尾静脉注射后,实验组和对照组的肿瘤摄取均随时间逐渐降低,肝、肾、膀胱摄取存在较高非特异性摄取。对照组和实验组肿瘤摄取虽然随着时间逐渐降低,但是实验组下降速率显著慢于对照组。实验组肿瘤摄取值显著高于对照组,对照组vs实验组(30min)= 1.53±0.17 %ID/g vs 2.07±0.26 %ID/g,P< 0.05,对照组vs实验组(60min)= 1.43±0.09 %ID/g vs 1.83±0.26 %ID/g,P< 0.05。此外,本实施例中68Ga-DOTA-DBCO在荷瘤小鼠体内生物分布数据如表2所示。
表2
实施例6 与Ac4ManNAz的体外点击化学反应验证
实施例4制得的68Ga-DOTA-DBCO与Ac4ManNAz的体外点击化学反应如图12所示,68Ga-DOTA-DBCO与Ac4ManNA孵育5 min,出现的新的反射峰,说明形成了新的放射性化合物,并且新放射峰的面积远远大于68Ga-DOTA-DBCO的放射峰面积。孵育30 min时,已经完全生成新的放射峰,证明68Ga-DOTA-DBCO已经被完全反应。由此可知,68Ga-DOTA-DBCO与Ac4ManNAz的点击化学反应在PBS溶液中可行,并且效率高。
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
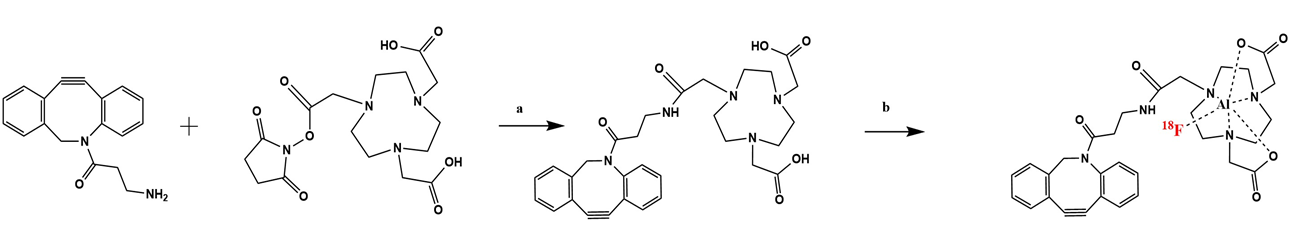
图 1
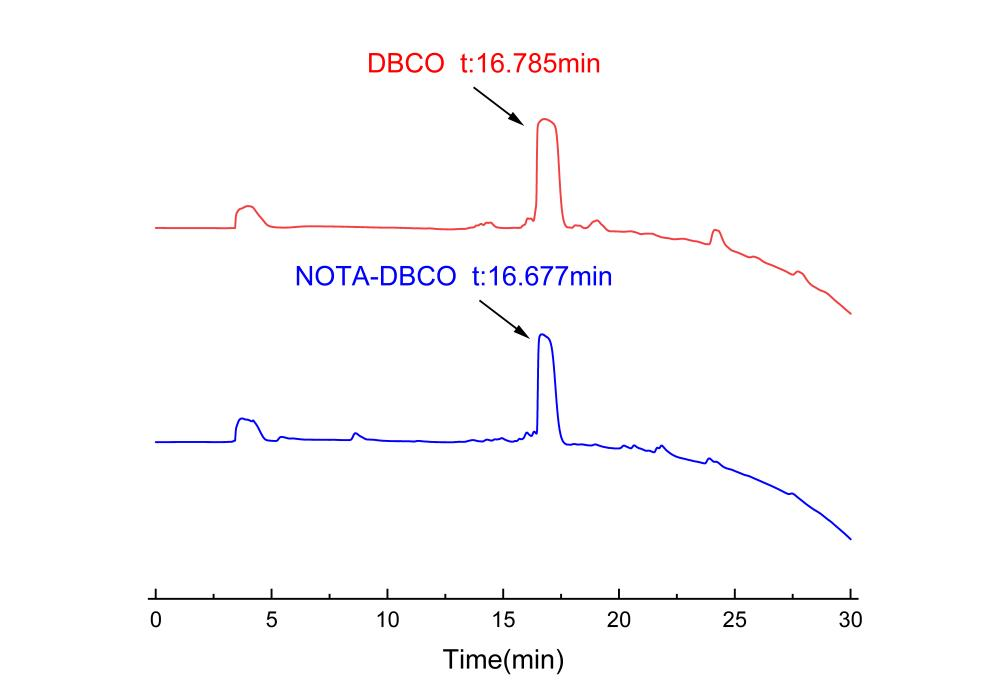
图 2
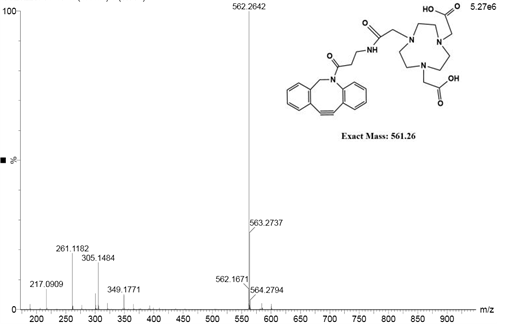
图 3
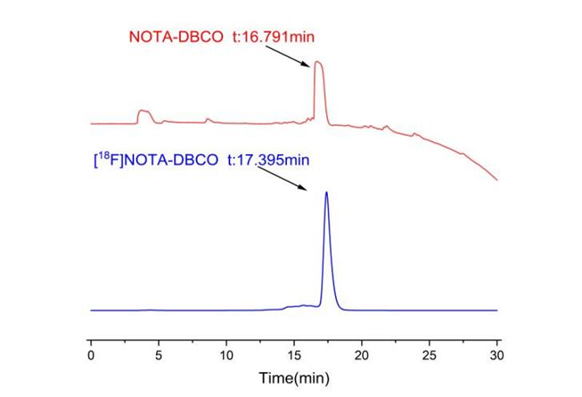
图 4
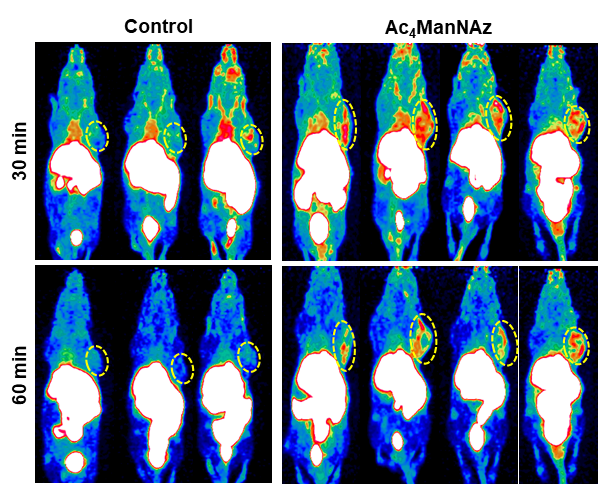
图 5
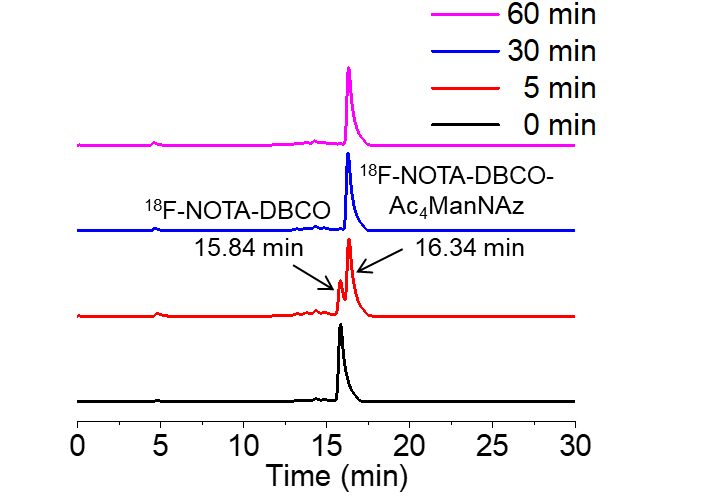
图 6
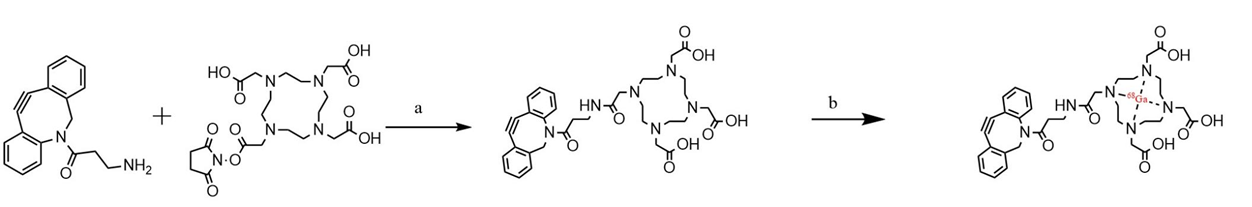
图 7
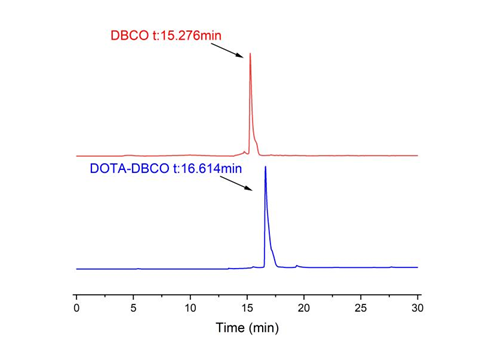
图 8
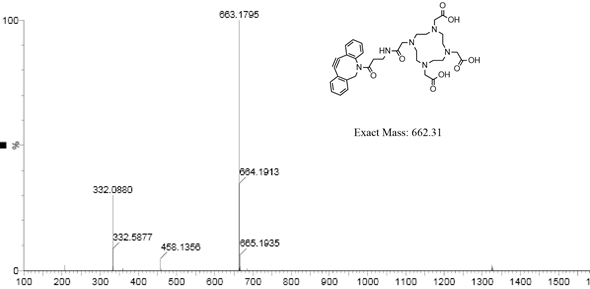
图 9
图 10
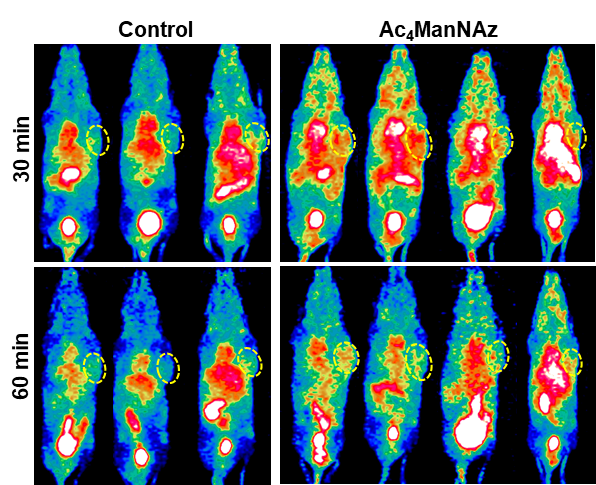
图 11
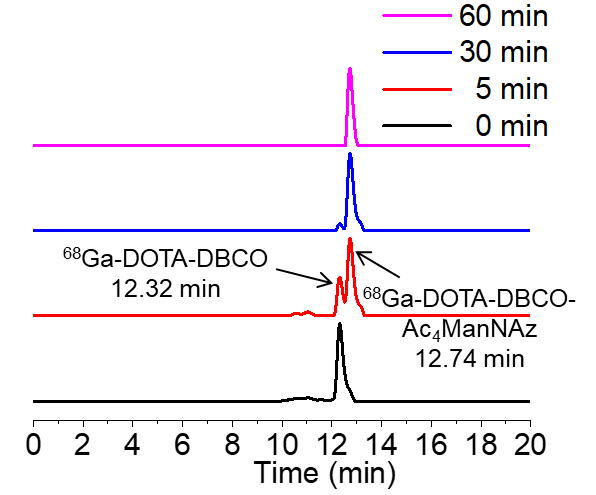
图 12
 揭榜条件
揭榜条件
为了确保本发明的成功转让及其后续应用,技术转让团队应满足以下要求:
1.技术专业性:
团队成员应具备医学影像学、放射性核素化学和药物开发等相关领域的专业知识和经验。至少应有一名成员具备放射性标记化合物的合成及应用经验,能够理解和实施本发明的制备方法和技术细节。
2.项目管理能力:
团队应具备项目管理的能力,能够有效规划和执行技术转让的各项任务,包括时间管理、资源调配和风险控制。应有明确的项目目标,并能够制定可行的实施方案以确保项目的顺利推进。
3.沟通与协调能力:
团队应具备良好的沟通能力,能够与相关利益方(如研发团队、临床医生、市场部门等)进行有效沟通,确保信息的顺畅传递。能够协调各方面的需求和意见,推动技术的顺利应用和市场化。
4.市场分析与推广能力:
团队应具备市场分析能力,能够对目标市场进行评估,识别潜在客户及其需求,制定相应的市场推广策略。了解放射性核素在医学影像学和肿瘤治疗中的应用前景,能够有效推广本发明的优势及应用价值。
5.合规与伦理意识:
团队成员应了解相关法律法规及伦理要求,确保技术转让及后续应用符合国家和地区的监管要求。应具备对临床研究和药物开发过程中的伦理问题的敏感性,确保患者安全和权益。
6.持续学习与创新能力:
团队应具备持续学习的能力,能够关注行业动态及最新研究进展,以不断优化和改进技术转让及应用策略。鼓励团队成员提出创新性建议,以推动技术的进一步发展和应用。









 关注清华海峡研究院
关注清华海峡研究院